序
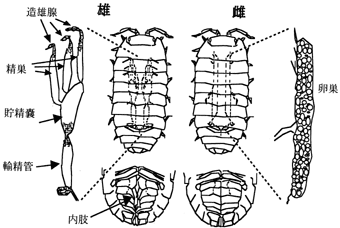 |
| 図1 ダンゴムシの性特徴 左に雄、右に雌ダンゴムシを示す。雄の内部生殖器官は造雄腺、精巣、貯精嚢、輸精管から、雌では卵巣から成る。雄の腹部腹面には雄外部生殖器官である内肢がある。 |
有性生殖を行う動物は個体発生の進行につれて雌雄の特徴が現れる。そして雌雄がそれぞれ卵子、精子を生じ、受精を行ない次世代を創る。すなわち、それぞれの種が地球上で増殖・繁栄するためには、個々の生物が雌雄にわかれる性決定・性分化は極めて重要な過程である。さらに、最初の生命体から今日地球上に生息するすべての動植物が進化してきたことを考えると、この基本的営みを支える共通の遺伝的仕組みがあるはずであろう。しかし、生物の生殖方法は極めて多様であり、分類学上ごく近縁とされる生物の間でも大きな違いが認められる。例えば、性決定において、哺乳類ではXとY染色体をもつ個体が雄になり、鳥類ではZとW染色体をもつ個体が雌になる。ある種の爬虫類では孵化温度によって性が決定される。魚類では遺伝的な性決定がおこるが環境要因によって機能的性転換がおこる。これらの脊椎動物では、性ホルモンの作用によって性分化が誘導されることが知られている。一方、節足動物門の昆虫ショウジョウバエでは細胞ごとに性が決まっており、性分化は厳密に遺伝的に決まっており、性ホルモンの関与は未だに明らかではない。ところが同じ節足動物門である甲殻類では性ホルモンの存在が知られている。すなわち、造雄腺と呼ばれる甲殻類の雄にのみ存在する組織で合成されるペプチド性の造雄腺ホルモンは、雄性化を促進する活性をもつ性ホルモンである(図11))。1954年、Charniaux-Cottonはオオハマトビムシを用いてはじめて造雄腺とそこから分泌されるホルモンの役割を解明した2)。その後、ダンゴムシをはじめとする多くの甲殻類で同様の現象が確認された3)。まもなくこのホルモンの精製が開始されたが、多くの研究者の努力にもかかわらず、つい最近までその正体は不明であった4,5)。
ダンゴムシは庭のすみの落ち葉の下や、植木鉢の裏あたりにいる、さわると丸くなる虫である。ムシと呼んでも昆虫ではなくエビ・カニなどと同じく甲殻類である。雌雄異体で、大きなものでは、オスが紫黒色になって斑紋はほとんどなく、メスは全体に色がうすくてはっきりした黄色の斑紋がある。つまり外見によって容易にオスメスを区別することができる。また図1に示したようにオスの腹部には内肢と呼ばれる外部生殖器があり、内肢の有無によっても性をわけることができる。このように性特徴がはっきりしており、入手が容易であることから甲殻類の性分化の研究をする上での実験材料としてダンゴムシを用いた。
そこで本研究においては、先ず、ダンゴムシの造雄腺抽出液および造雄腺部分精製物を用いて造雄腺ホルモンの物理化学的性質を検討し、造雄腺ホルモンの精製を行いN末端アミノ酸配列を解析した。次いで、それらの配列を基にプライマーを設計しPCRを行うことによって造雄腺ホルモン前駆体cDNAを単離し構造を明らかにした。さらに、cDNAとバキュロウイルス、大腸菌発現システムを用いて組換え前駆体ホルモンを合成し、リシルエンドペプチダーゼで消化した結果、活性をもつ分子を得ることができた。また配列を基に作製した抗体が造雄腺抽出液の活性物質を特異的に吸着することができることがわかった。以上のことから、得られたcDNAが造雄腺ホルモンの配列を担っていることを確定することができた。
1.ダンゴムシの造雄腺ホルモンの性質と精製
精製を試みるにあたってまず造雄腺ホルモンの性質を調べた。造雄腺のみ、および造雄腺と精巣由来の試料を用い、酸性、および中性の条件下で熱処理の活性への影響を調べたところ、酸性条件下ではいずれも活性は影響を受けなかったが中性条件下では造雄腺のみの試料にだけ活性が残った。この結果から造雄腺ホルモン自身は熱に強く、精巣内に中性条件下で造雄腺ホルモンと相互作用する物質が存在することが示唆された。また、トリプシン消化または還元処理により失活したことからジスルフィド結合を含むペプチドであると推定された。さらに、レクチンカラムに活性が吸着されたことからN結合型の糖鎖をもった糖ペプチドであると予想された。またゲルろ過高速液体クロマトグラフィー(HPLC)によって、分子量が約12,000と推定された。
すなわち造雄腺ホルモンは熱に安定なジスルフィド結合を有した分子量約12,000の糖ペプチドであることが示唆された6)。
そこでダンゴムシの造雄腺だけを材料にして造雄腺ホルモンの精製を開始した。2000匹のダンゴムシの造雄腺の抽出物から3段階のHPLCを経て、単一ピークにまで精製することができた(図2)。得られた量は0.16 gであり、そのうちの38 pgを若い雌に注射すると雄への性転換活性が認められた。さらに12,000匹と12,500匹から造雄腺ホルモンを精製した結果、同程度の性転換活性を有する画分を得た。2000匹と12,500匹から精製した画分のアミノ酸配列解析の結果から、それらは同じ配列を有することがわかったが、造雄腺ホルモンは2本鎖のペプチドであることが示唆された。そこで、12,000匹から精製した画分を還元カルボキシメチル化し、HPLCで分離したところ、得られた画分は先に解析した2本鎖の配列のうちの一つの配列を有することが分かった。つまり3回の精製によって得られた画分から同じ配列が得られたこと、およびそれらが同程度の比活性を示したことからこの配列が造雄腺ホルモン本体に由来することが期待された(表17))。一方、フランスのマルタンらはほぼ同時期に造雄腺ホルモン含有量を高めた間性ダンゴムシを用いて造雄腺ホルモンを精製し、その部分配列を明かにした。この配列は筆者の配列と同一のものと考えられた8)。
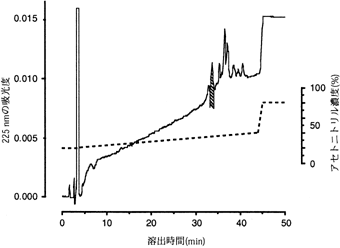 |
| 図2 3回目の逆相HPLC カラム:Asahi Pak ODP-50(4.6×150 mm)。溶出液:0.05% HFBA中20-40%アセトニトリル濃度勾配。流速 1 ml/min。検出:225 nmの吸光度。温度:40℃。アセトニトリル濃度は点線で示された。斜線は造雄腺ホルモン活性を表す。 |
| 表1 造雄腺ホルモンの精製のまとめ | |||
|
|
|||
| 精製のロット番号 |
1
|
2
|
3
|
|
造雄腺2000匹分
抽出液 |
造雄腺12500匹分
抽出液 |
造雄腺12000匹分
抽出液 |
|
|
|
|||
| 回収率 (%) |
11
|
8.7
|
12
|
| 総タンパク質量 (μg) |
0.16
|
0.024
|
0.10
|
| 総活性量 (k units) |
4.1
|
0.97
|
3.0
|
| 比活性 (pg protein/unit) |
38
|
25
|
33
|
|
|
|||
| 1 unitは若い雌に注射したとき、50%の雌が雄性化する活性の強さを表す。 | |||
2.ダンゴムシの造雄腺ホルモンのcDNAクローニングと発現解析
アミノ酸配列解析の結果から得られた配列とマルタンらによって明らかにされた部分配列をもとにcDNAのクローニングを行った。塩基配列解析の結果からアミノ酸配列を演繹したところ、アミノ酸配列はまったく異なるが、インスリン前駆体と類似のドメイン構成を有することが明らかとなった。すなわち、21残基のシグナルペプチドに続いて44残基のB鎖、45残基のCペプチド、そして最後に29残基のA鎖から成っていた。このうちB鎖とCペプチド、およびCペプチドとA鎖の間にはそれぞれ連続した2残基の塩基性アミノ酸が存在していた。先にアミノ酸配列解析によって得られた2本の配列は演繹したA鎖、B鎖の配列と一致した。A鎖、B鎖にはそれぞれ4個のシステイン残基が存在した。また、A鎖にはN結合糖鎖の共通配列が1ヵ所存在した。ノーザンブロット解析によってこの遺伝子の発現を調べたところ、造雄腺にのみ発現が認められ、そのサイズは約0.8 kbであった。
3.ダンゴムシの造雄腺ホルモンの構造と活性
単離したcDNAが造雄腺ホルモン自身をコードしていることを証明するために、このcDNAを改変し、バキュロウィルスと大腸菌の発現系を利用して組み換え体ペプチドを合成し、性転換活性を示すかどうかを調べた。さらに、A鎖のN末端部、B鎖のN末端部、大腸菌で発現した組換えタンパク質をそれぞれ抗原として得られた特異的抗体が造雄腺ホルモン活性を吸着するかどうかを調べた。
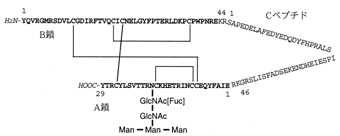 |
| 図3 バキュロウイルス発現系による組換えプロ造雄腺ホルモンの構造 |
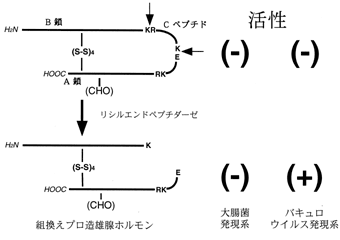 |
| 図4 酵素消化による活性の変化 |
クローン化したcDNAとバキュロウイルス発現システムを用いて糖鎖とCペプチドを有するホルモン前駆体型の組換え体ペプチドを発現させた(図3)。また、同様に大腸菌で発現させたものには糖鎖が付加されていなかった。このCペプチドを有する2つの組換えタンパク質そのものは活性を示さなかったが、糖鎖を有する組換えペプチドにリシルエンドペプチダーゼを用いてCペプチドの一部を切り取り2本鎖となった組換え体ペプチドは天然ホルモンの約十分の一の活性を示した(図4)。同様に糖鎖をもたない大腸菌発現組換え体ペプチドを同様に処理したが、活性は示さなかった。これらのことから、造雄腺ホルモン活性物質はこのcDNAにコードされており、Cペプチドの切断による二本鎖の形成が活性をあらわすのに必須であることがわかった。さらに、糖鎖と活性の関係を調べるために、活性を有する組換え体ペプチドをグリコペプチダーゼで消化しN結合型糖鎖を切断したところ、活性がほぼ消失した。この結果は造雄腺抽出液を同様に酵素消化した時活性が低下したことと一致した。これらのことから造雄腺ホルモン活性に糖鎖が必須であることが示された。また、3種類の特異的抗体を作製し、これらを用いて免疫沈降を行った結果、造雄腺抽出液中の活性物質が抗体に吸着し、活性をもたない大腸菌発現組換え体ペプチドによって吸着が阻害された。この結果もクローン化したcDNAが造雄腺ホルモンをコードしていることを支持した。以上の結果からダンゴムシの造雄線ホルモンはN結合型糖鎖をもつ2本鎖ペプチドであり、先ずプレプロ造雄腺ホルモンからシグナルペプチドが除去され、4対のジスルフィド結合が形成された後にCペプチドがLys/Arg-Arg部位で切断されることによって二本鎖となり成熟ホルモンが形成されると推定された。
今後
世界各地で養殖されているエビ・カニ類は他の多くの水産動物と同じく成長に雌雄差がある。成長の早い性の方が好まれるため、単性養殖技術の確立が望まれている。これを実現するためには生理的な性制御技術を確立することが必要である。ダンゴムシの造雄腺ホルモンに関する本研究の知見をエビ・カニのような十脚目に応用することによって単性養殖技術の確立へと将来発展する可能性も出てきた。また、現在社会的に問題となっている環境ホルモンの生殖系への作用機構を解明する上で甲殻類の性の制御が良いモデル系を提供することが期待される。
従来の甲殻類の性分化に関する研究は移植実験や構造の観察が主であったが本研究の成果により、活性を有する組換え造雄腺ホルモン、cDNA、抗体を用いた分子レベルの研究が可能となった。今後、造雄腺ホルモンの発現および時期の調節、造雄腺細胞内での翻訳後修飾の調節などを詳細に解析することによって甲殻類の性分化の分子機構をさらに深く理解できるようになると思われる。ステロイドホルモンによって性分化が誘導される哺乳類などとは違って、ペプチドホルモンが性分化を誘導していることは、比較内分泌学的な視点から面白いと考えている。
本研究によって甲殻類の性分化の鍵を握るホルモンの構造が明らかになった。この成果は甲殻類のみならず動物界全体での性分化機構を分子レベルで解析していくための基礎になることが期待される。
謝辞
本研究は東京大学大学院農学生命科学研究科応用生命化学専攻・長澤寛道先生、慶應義塾大学生物学教室・長谷川由利子先生のご指導のもとに行われた。深く感謝申し上げます。
引用文献
1. 長澤寛道 (1997) バイオサイエンスとインダストリー, 55, 845-849.
2. Charniaux-Cotton, H. (1954) C. R. Acad. Sci. Paris 239, 780-782.
3. Hasegawa, Y. et al. (1993) Amer. Zool. 33, 403-411.
4. Berreur-Bonnenfant, R. R. et al. (1973) C. R. Acad. Sci. Ser. D 277, 971-974
5. Nagasawa, H. et al. (1995) Biosci. Biotechnol. Biochem. 59, 1246-1250
6. Okuno, A. et al. (1997) Zool. Sci. 14, 837-842.
7. Okuno, A. et al. (1999) Biochem. Biophys. Res. Commun. 264, 419-423.
8. Martin, G. et al. (1999) Ann. N.Y. Acad. Sci. 839, 117-117.